Sygeplejersken
Sådan foregår strålebehandling
Cirka halvdelen af alle cancerpatienter vil på et tidspunkt i deres sygdomsforløb modtage strålebehandling. Enten som primær behandling, i forbindelse med tilbagefald eller som palliation. I artiklen gennemgås stråleterapiens biologi, fysik og teknik.
Sygeplejersken 1998 nr. 30, s. 30-33
Af:
Mette Skovhus Thomsen, hospitalsfysiker

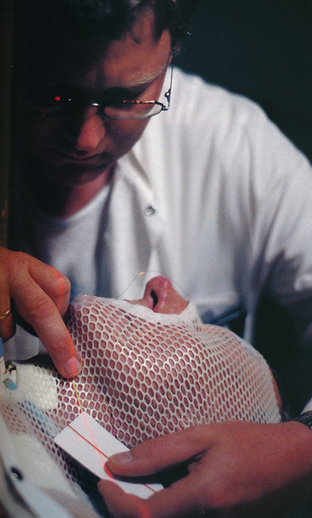 Behandlingssimulering af patient med cancer på stemmebåndene. Behandlingen simuleres ved hjælp af et almindeligt røntgenrør – formålet er at opmærke strålefelterne. Foto: Kissen Møller Hansen.
Behandlingssimulering af patient med cancer på stemmebåndene. Behandlingen simuleres ved hjælp af et almindeligt røntgenrør – formålet er at opmærke strålefelterne. Foto: Kissen Møller Hansen.
Strålebehandling er sammen med kirurgi de væsentligste behandlingsformer ved cancersygdomme. Det er blevet anslået (1), at når der diagnosticeres 100 nye tilfælde af cancer, vil lige knap halvdelen blive helbredt. Af disse vil cirka 50 procent blive helbredt med kirurgi, mens 40 procent bliver helbredt med strålebehandling som den mest betydende behandlingsform. For de sidste 10 procent er det kemoterapi, der enten alene eller i kombination med andre typer af behandling fører til helbredelse.
I denne artikel vil vi se på, hvad det er for en slags stråling, der benyttes ved stråleterapi, og hvilke fysiske og biologiske processer strålingen sætter i gang i vævet. Desuden vil planlægningsforløbet for en behandling med kurativt sigte blive beskrevet.
I kurativt øjemed benyttes strålebehandling som den primære behandling ved tumorer i hoved-halsområdet (mundhulen, struben etcetera), livmoderhalsen og blæren samt i huden (2). Her har strålebehandling den klare fordel frem for kirurgi, at den er organbevarende. En patient med strubecancer vil således efter endt behandling stadig kunne tale normalt. Stråling kan også anvendes som supplerende behandling, som det sker ved brystkræftpatienter, der har fået foretaget en brystbevarende operation.
Formålet med kurativ stråleterapi er at give en så høj og så homogen dosis som muligt til det syge væv uden at forårsage uønskede og unødvendige bivirkninger for patienten. Det betyder, at målet med behandlingen ikke udelukkende er at ødelægge tumorcellerne og dermed forlænge livet for patienten, men også at give patienten et efterfølgende liv med en god kvalitet. Det har stor betydning, når man tager i betragtning, at omkring 30 procent af de personer, der får stillet diagnosen cancer, er i live 10 år efter diagnosetidspunktet.
Som palliativ behandling bliver stråleterapi også hyppigt anvendt. Det benyttes til smertelindring ved knoglemetastaser, hvor mere end 75 procent af patienterne bliver symptomfrie efter behandlingen. Strålebehandling kan også anvendes ved hjernemetastaser, rygmarvskompression og lungecancer. Totaldosis ved en sådan behandling er ikke så høj som ved en kurativ behandling, og typisk gives denne dosis over nogle få (1-4) behandlinger.
Alt i alt vil omkring halvdelen af alle cancerpatienter på et tidspunkt i deres sygdomsforløb modtage strålebehandling (1) enten som del af deres primære behandling, i forbindelse med tilbagefald eller som palliation.
Strålebehandling stiller meget store krav til personalets ekspertise og erfaring samt til apparaturet, som er komplekst og kræver store investeringer. Derfor er stort set al strålebehandling i Danmark samlet seks steder i landet. Det er på Rigshospitalet, Københavns Amts Sygehus i Herlev, Odense Universitetshospital, Vejle Sygehus, Århus Kommunehospital og Aalborg Sygehus.
Røntgenstråling
Den type stråling, der primært benyttes ved strålebehandling, er røntgenstråling. Det er den samme type stråling, som anvendes ved røntgenoptagelser. Blot er røntgenstråling til terapiformål langt mere intens, idet der rammer mange flere stråler inden for et givent område. Desuden er strålingen meget mere gennemtrængende. Den slags røntgenstråling dannes i en stor maskine kaldet en accelerator.
Gennemtrængningsevnen for terapeutisk røntgenstråling kan beskrives med et eksempel fra dagligdagen. Holder man et almindeligt stykke papir op foran en tændt elektrisk pære, vil lyset blive dæmpet. Hvis man lægger flere og flere stykker papir oven på hinanden foran pæren, vil man til sidst ikke se noget lys trænge igennem papirlaget. Når det drejer sig om røntgenstråling til terapiformål, skal der være flere meter beton mellem acceleratoren, der laver strålingen, og et apparat, der kan måle røntgenstråling, før apparatet ikke længere kan registrere strålingen. Derfor er behandlingsrummet, hvori acceleratoren er placeret, også omgivet af meget tykke betonmure, for at personalet og andre, der færdes i og omkring bygningerne, ikke udsættes for unødvendig stråling.
Elektronstråling
Acceleratoren kan også lave elektronstråling, der i modsætning til røntgenstråling ikke kan trænge særligt langt ind i væv. Elektronstrålingens egenskaber i væv kan sammenlignes med at kaste sten ned i en snedrive. Stenene trænger et stykke ned i sneen, men bliver så standset af sneen. Kaster man stenene ned med lidt mere kraft, vil de trænge lidt dybere ned svarende til at anvende elektronstråling med en lidt højere energi. Elektronstrålingen anvendes for eksempel i forbindelse med behandling af thoraxvæggen hos patienter, der har fået fjernet brystet. Kendes tykkelsen af vævet ind til lungen (for eksempel bestemt ved hjælp af ultralyd), kan man vælge energien af elektronstrålen, så strålingen stoppes, lige inden den kommer til lungen. Lungen er et strålefølsomt organ, hvori der kan udvikles fibrose efter
Side 31
bestråling, og det er derfor ikke fordelagtigt at anvende den gennemtrængende røntgenstråling ved denne type behandling.
Når man angiver energien af strålingen fra behandlingsapparatet, benyttes en speciel energienhed kaldet elektronvolt (eV). En elektronvolt er den energi, en elektron opnår ved at bevæge sig igennem en spændingsforskel på en volt. Stråling til terapiformål har typisk energier i området 4-18 MeV (millioner elektronvolt).
Skader som følge af stråling
Elektron- og røntgenstråling kaldes også ioniserende stråling. Ioniserende stråling har nogle ganske særlige egenskaber sammenlignet med ikke-ioniserende stråling som eksempelvis lys. Når den ioniserende stråling passerer gennem væv, vil den overføre energi til de atomer, som er vævets basale byggesten. Mere korrekt er det nogle af de elektroner, der omgiver atomerne, der modtager energien. Disse elektroner bliver derved i stand til at rive sig løs fra atomet (man siger, at atomet bliver ioniseret). Da det er de atomare elektroner, der binder atomerne sammen i molekyler, kan sådanne ionisationer resultere i, at molekylet går i stykker. Sker der tilstrækkeligt mange af den slags processer i cellekernens DNA, vil der opstå brud på DNA-kæderne, hvilket kan føre til mutationer eller i sidste ende celledød.
Når man inden for strålefysikken skal beskrive, hvor meget energi den ioniserende stråling afsætter i vævet, benyttes udtrykket absorberet dosis, som angiver den absorberede energi per masseenhed. Den typiske dosis til en patient ved en enkelt behandling er omkring to J/kilogram. Det svarer til, at energiindholdet i denne mængde ioniserende stråling kunne opvarme et kilogram væv 0.0005°C. Patienten mærker således ikke nogen opvarmning af vævet under behandlingen. Der kan dog senere komme nogle reaktioner i huden som følge af de biologiske processer, som strålingen har induceret.
De fysiske ionisationsprocesser foregår udelukkende, mens strålingen passerer gennem vævet. Det betyder, at disse processer stopper, samtidig med at strålingen fra behandlingsapparatet stoppes. Når patienten går fra behandlingsrummet er det derfor de kemisk/biologiske processer (for eksempel enzymreaktioner, celledelinger), der har taget over. Tidsskalaen for de biologiske følger af strålingen er meget lang. Nogle typer væv reagerer hurtigt på stråling. Det er ud over strålefølsomme tumorer eksempelvis hud og slimhinder i mund, svælg og tarm. Hos andre typer af væv for eksempel rygmarven og øjelinsen optræder eventuelle skader først år efter, behandlingen er ophørt (senskader).
Da cellerne har en vis evne til at udbedre fejl i DNA-strengene, vil nogle af de stråleinducerede skader i cellekernen blive repareret inden for de første cirka seks timer efter behandlingen. Herved kan nogle af de stråleskadede celler komme til at fungere igen, mens andre celler, hvori denne reparation ikke er lykkedes, dør.
Det ville være ideelt, hvis det kun var tumorcellerne, som blev destrueret ved strålebehandlingen, men strålingen er desværre ikke selektiv. Det betyder, at også normale celler dør. Her har man dog fundet frem til, at det er optimalt at dele stråledosis ud over mange
Side 32
behandlinger (fraktioner). Typisk gives 25-30 fraktioner med fem fraktioner per uge (mandag-fredag). Ved at give den totale dosis over mange fraktioner, kan man udnytte cellernes evne til reparation af stråleinducerede skader. Det er især det normale væv, der opnår en gavnlig effekt af dette, hvorved man kan reducere bivirkningerne for patienten uden at opnå en dårligere kontrol med tumor.
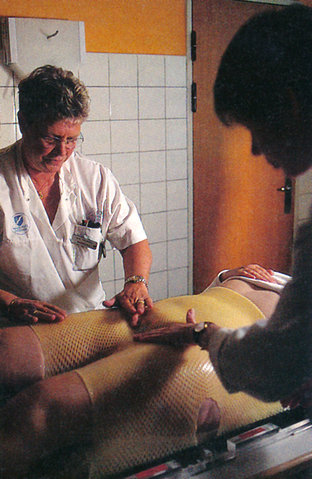 Fremstilling af behandlingsskal til patient med kræft i livmoderhalsen. Behandlingsskallerne sikrer en ensartet lejring, således at hele tumorområdet bestråles, mens bestråling af normalt væv minimeres.
Fremstilling af behandlingsskal til patient med kræft i livmoderhalsen. Behandlingsskallerne sikrer en ensartet lejring, således at hele tumorområdet bestråles, mens bestråling af normalt væv minimeres.
Patientfikseringsskaller
Et af de vigtige mål ved planlægningen af behandlingen er at sikre, at hele tumorområdet er inkluderet i strålefeltet, og samtidig reducere mængden af normalt væv til et minimum. Det er ligeledes vigtigt, at patientens bevægelser under behandlingen er minimale, og at hans/hendes lejring kan gentages gennem hele behandlingsforløbet. Til dette formål fremstilles individuelle patientfikseringsskaller.
Der anvendes forskellige typer af fikseringsskaller alt efter, hvor på kroppen patienten skal behandles. For få år tilbage lavede man fikseringsskallerne ud fra gibsafstøbninger af patienten. Dette gav imidlertid personalet mange tunge løft, ligesom patienten måtte møde en gang ekstra i afdelingen i forberedelsesfasen. I dag benyttes en såkaldt vac-lock pose, til blandt andre brystkræftpatienter. Det er en stor, kraftig plasticpose, der indeholder små Krøyerkugler, som er lavet af polystyren. Når patienten er anbragt på posen, og kuglerne i posen er formet rundt om patientens arme, hoved og skuldre, pumpes posen tom for luft. Herved bliver kuglerne presset sammen til en hård skal med aftryk af patienten, så hun kan ligge på præcis samme måde ved hver behandling.
Patienter med tumorer i hoved/halsområdet og i bækkenregionen får lavet en plasticoverskal. Til dette benyttes en særlig type plastic, som har den egenskab, at det bliver blødt ved en temperatur på cirka 60°C. Forud for fremstillingen af en overskal blødgøres termoplasten i et varmt vandbad. Før plasten lægges over den del af patienten, der skal behandles, køles den ned, så den ikke føles ubehagelig varm for patienten. Plasten fastgøres på begge sider af patienten, og idet den køler helt ned stivner den, hvorved patientens facon vil være bevaret i skallen.
En hospitalsfysiker arbejder med medicinsk strålingsfysik, det vil sige anvendelse af ioniserende stråling på patienter. Det kan være ved strålebehandling af cancerpatienter, inden for nuklearmedicin eller ved røntgendiagnostik. For at blive ansat i en hospitalsfysikerstilling skal man have en teknisk naturvidenskabelig uddannelse enten som civilingeniør eller cand. scient. med fysik som hovedfag.
Efter ansættelsen skal man gennemgå et cirka treårigt individuelt uddannelsesprogram for at kunne opnå Sundhedsstyrelsens godkendelse som kvalificeret hospitalsfysiker. I Danmark er der omkring 50 hospitalsfysikere, hvoraf cirka 10 arbejder inden for nuklearmedicin og fem inden for røntgendiagnostik, mens de øvrige er beskæftiget med onkologisk strålebehandling.
Fysikerens arbejdsopgaver er i samarbejde med onkologen at planlægge behandlingsforløbet for den enkelte patient. Desuden foretager fysikeren dosisberegninger for den enkelte patient samt kontrollerer, at patienten faktisk får den planlagte behandling. Fysikeren medvirker også ved indførelse af nye behandlingsmetoder og ny teknologi. Det er endvidere fysikerens opgave at rådgive i forbindelse med spørgsmål angående strålebeskyttelse for såvel arbejdstagere som befolkningen som helhed.
Terapiscanning
For nogle patienter inkluderer planlægningen af behandlingen også en speciel CT-scanning, kaldet en terapiscanning. Ved en sådan scanning bliver patienten scannet i behandlingsskallen, da formålet er at få tumor indtegnet på CT-snittene optaget med patienten lejret på samme måde, som han/hun vil være det i det efterfølgende behandlingsforløb.
CT-billederne overføres til en stor computer – et såkaldt dosisplanlægningssystem, hvor billedinformationen kan præsenteres svarende til at betragte patienten fra mange forskellige retninger i rummet. Her foretages den egentlige planlægning af behandlingen, det vil sige, det fastlægges, hvor mange strålefelter behandlingen skal sammensættes af, ligesom den optimale rumlige vinkling mellem patienten og behandlingsapparatets strålehoved bestemmes.
Dette arbejde udføres af en fysiker i samarbejde med en speciallæge i onkologi. Med et dosisplanlægningssystem har fysikeren optimale forhold til at finde frem til en behandlingsplan, som giver den ønskede dosis til tumor samtidig med, at dosis til det normale væv og eventuelle strålefølsomme organer reduceres mest muligt. Hvis det for eksempel drejer sig om en hjernetumor, er det vigtigt, at strålefelterne ikke går igennem et øje. Øjelinsen er meget strålefølsom, og der kan udvikles katarakter ('grå stær') i
Side 33
løbet af nogle år efter bestråling med selv en forholdsvis lav dosis.
Lignende overvejelser gælder ved planlægning for tumorer, der ligger i nærheden af rygmarven. Rygmarven er ikke så strålefølsom som øjelinsen, men der er en øvre grænse for den dosis, den må få for at undgå stråleinducerede skader. Denne dosis ligger under den dosis, som tumoren skal have, og det gælder derfor om at planlægge strålefelterne således, at den maksimale dosis til rygmarven ikke overskrides.
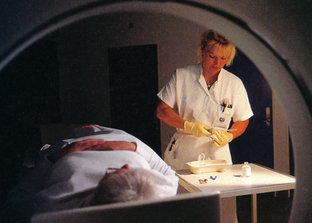 CT-scanning, en såkaldt terapiscanning, af patient med livmoderhalskræft. Patienten bliver scannet i behandlingsskallen, da formålet er at få tumor indtegnet på CT-snittene med patienten lejret på samme måde, som patienten vil være det i det efterfølgende behandlingsforløb.
CT-scanning, en såkaldt terapiscanning, af patient med livmoderhalskræft. Patienten bliver scannet i behandlingsskallen, da formålet er at få tumor indtegnet på CT-snittene med patienten lejret på samme måde, som patienten vil være det i det efterfølgende behandlingsforløb.
Behandling simuleres
Et par dage før patienten starter på behandlingen, skal han/hun til simulering. Her simulerer man behandlingen ved hjælp af et almindeligt røntgenrør, der er monteret på samme måde som strålehovedet på behandlingsapparatet. Det vil sige, det kan bevæge sig 360° rundt om lejet, hvor patienten ligger. Har patienten fået lavet en CT-baseret dosisplan, foregår simuleringen stort set ved at placere patienten i forhold til strålehovedet som bestemt ved planlægningen og opmærke strålefelterne samt verificere disse med almindelige røntgenbilleder (simulatorbilleder).
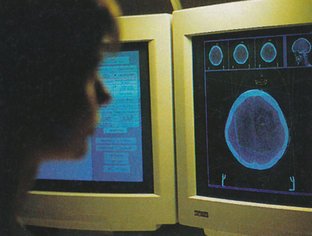 Hospitalsfysikeren laver dosisplanlægning til patient med hjernetumor.
Hospitalsfysikeren laver dosisplanlægning til patient med hjernetumor.
For patienter, der ikke er dosisplanlagt, vil en læge i samarbejde med en radiograf eller fysiker ved gennemlysning af patienten bestemme, hvorledes strålefelterne skal placeres og derefter optegne dem på patienten. Optegningerne bruges til indstilling af behandlingsapparatet. Hvis patienten ikke har nogen behandlingsskal eller kun har en bagskal foregår optegningen direkte på huden med noget speciel farve, som kan tåle, at man går i bad, uden det vaskes af. For patienter med forskal laves markeringerne på skallen.
Der mangler nu kun nogle sidste forberedelser, inden patienten kan starte på behandlingen. Strålefeltet fra et behandlingsapparat er af tekniske grunde altid firkantet, mens det område i patienten, der skal have bestråling i de fleste tilfælde ikke har den facon. Derfor markerer lægen på simulatorbillederne det område i strålefeltet, der ikke skal have stråling. Der fremstilles derefter en blyblok, en afdækning, der vil reducere strålingen i det markerede område.
Til slut skal det så beregnes, hvor meget stråling patienten skal have på de enkelte strålefelter for at få den dosis, som lægen har ordineret. Dette tastes ind i behandlingsapparatets computer, hvor der er indbygget et kontrolsystem, der sikrer, at patienten får den foreskrevne behandling. Alt er nu klar til, at patienten kan modtage den første behandling.
Litteratur
- Twaites, D., Scalliet, P., Leer, J.W., & Overgaard, J. Quality assurance in radiotherapy. Radiotherapy and Oncology 1995; 35: 61-73.
- Steel, G.G. (ed.). Basic Clinical Radiobiology for Radiation Oncologists. London: Edward Arnold Publishers 1993.
Nøgleord: Cancer, kræft, palliation, strålebehandling.
Forfatteren er ansat på Århus Kommunehospitals afdeling for medicinsk fysik.
