Sygeplejersken
Hvornår har patienten behov for blodtransfusion?
Transfusion af donorblod er en af få behandlinger, som kan genoprette iltningen af vævet, når efterspørgslen af ilt overstiger tilbuddet. Transfusion med donorblod er derfor livreddende til patienter med akut ukontrollabel blødning.
Sygeplejersken 2011 nr. 8, s. 58-61
Af:
Jens Svanholt Seeberg, sygeplejerske, cand.scient.san.

Artiklen skal
- gøre læseren bevidst om, hvorfor det er vigtigt at have en restriktiv tilgang til transfusion med donorblod
- præcisere, hvornår en patient har anæmi
- tydeliggøre, hvilke patienter der kan have fordele af transfusion med donorblod
- beskrive ulemper og bivirkninger ved transfusion med donorblod.
De ord i teksten, som er mærket med *), er forklaret i boks 1. Ordene i listen er ordnet i alfabetisk rækkefølge.
Acute Physiology And Chronic Health Evaluation APACHE er et udbredt risikoscoringssystem til intensive patienter.
Allogene celler: Ved allotransplantation flyttes væv/celler fra én person til en anden. Modsat autolog/autotransplantation, hvor vævet flyttes hos personen selv.
Hb-koncentration: Koncentrationen af hæmoglobin i blodet, målt i millimol pr. liter (mmol/l) eller gram pr. deciliter (g/dl). Hæmoglobin findes inde i erytrocytterne og består af fire proteinkæder (globin) med hver en hæmgruppe og en iltbindende divalent jern-ion (Fe2+).
Hæmatokrit: Volumenprocenten af røde blodlegemer i blodet, et udtryk for blodets evne til at transportere ilt.
Iltekstraktion: Afgivelse af ilt fra hæmoglobinmolekylet til væv.
Konfunderende faktor/Confounder: En confounder er en faktor, der kan påvirke resultatet. For at kunne sammenligne risikoen i to eksponeringsgrupper skal de være sammenlignelige.
Normovolæmisk: Normal volumen i blodbanen.
OR: Oddsratio; odds for et uønsket udfald i behandlingsgruppen divideret med odds i kontrolgruppen.
SAGM: Erytrocytkoncentrat bestående af ca. 170 ml erytrocytter, 100 ml saltvand (SAG-M) og kun 5-10 ml plasma. Leucocytindholdet er reduceret med over 75 pct. Indeholder ingen trombocytter og koagulationsfaktorer. Ved massivt transfusionsbehov bør der derfor også gives friskfrosset plasma og evt. trombocytkoncentrat.
TRALI: Transfusion related acute lung injury. Det typiske billede ved TRALI består af akut indsættende alvorlig dyspnø, tachypnø, ny eller tydeligt forværret hypoxi, feber, hypotension og evt. cyanose under eller efter transfusion. Mortaliteten ved TRALI og ”delayed TRALI” hos kritisk syge patienter er høj, omkring 40 pct. Alle kan få TRALI, men hyppigheden er størst hos intensive patienter. En klinik med 1.000 indlæggelser pr. år giver en forventet forekomst af TRALI på mellem 3 og 13 pct. (ved en transfusionsfrekvens på 40 pct.).
Viskositet: Tykkelse af væske, f.eks. blod (jo flere røde blodceller, des tykkere blod/højere viskositet).
Vævshypoxi: Utilstrækkeligt ilttilbud til væv.
Transfusion af donorblod er en af få behandlinger, som kan genoprette iltningen af vævet, når efterspørgslen af ilt overstiger tilbuddet. Transfusion med donorblod er derfor livreddende til patienter med akut ukontrollabel blødning. Fordelene, når det gælder patienter, som ikke bløder akut, er til gengæld sværere at præcisere.
Transfusion med donorblod øger altid blodvolumen. For nogle patienter vil transfusionen ikke øge ilttilbuddet til væv, men kun behandle hypovolæmi og dermed bedre patienten alment.
Volumenbehandling bør dog gives med andre og mere sikre væsker. Beslutningen om, hvorvidt en stabil patient skal have transfusion med donorblod, afhænger derfor ofte af det kliniske personales vurdering af fordele og ulemper for den enkelte patient.
Sygeplejersker er her en vigtig faggruppe. Da transfusion med donorblod aldrig vil blive en behandling uden risici, bør unødvendige transfusioner undgås.
Optimal transfusionsbehandling opnås ved at bruge transfusionsvejledninger, der på basis af videnskabelig evidens sandsynliggør, at patienten samlet set har gavn af behandlingen (1). I denne artikel vil evidens for transfusion af røde blodlegemer (RBC)/SAGM*) blive diskuteret.
Artiklen beskriver fysiologiske principper for transport af ilt, kompensatoriske mekanismer ved anæmi og effekten af transfusion med donorblod på ilttransport og iltoptagelse i væv. Sidst, men ikke mindst præsenterer artiklen den aktuelle viden om risici ved blodtransfusion målt på mortalitet og morbiditet.
Vi er storforbrugere af donorblod
Danmark er det land i den vestlige verden, som transfunderer flest RBC. Vi transfunderer ca. 60 portioner RBC pr. 1.000 indbyggere (2008).
Gennemsnittet for lande i EU og USA er 40 portioner pr. 1.000 indbyggere, se figur 1. I alt giver vi i Danmark ca. 200.000 portioner RBC om året, og sygeplejersker deltager i op til 75 pct. af beslutningerne vedr. transfusion.
Derfor har sygeplejersker væsentlig indflydelse på transfusionsbehandlingen af danske patienter, og de bør af samme grund have indgående viden om fordele og ulemper med behandlingen.
Blodmanagement
For at imødekomme det kliniske personales behov for sparring med specialister har flere vestlige lande iværksat blodmanagement. Blodmanagement handler om korrekt brug af donorblodprodukter, brug af alternativer til donorblod og strategier til at reducere eller undgå patienternes behov for blodtransfu- sion.
Blodmanagementprojekter benytter en tværfaglig teamstruktur til at imødegå patienters behov for blodtransfusion. Rigshospitalet har oprettet en sygeplejefaglig blodmanagerstil- ling i lighed med international praksis. Målet er, at sygeplejersker udvikler en fælles praksis for optimering af patienternes egne blodressourcer samt benytter evidensbaseret behandling.
Den sygeplejefaglige blodmanager på Rigshospitalet har ansvaret for udviklingen af fælles praksis i sygeplejen og for, at sygeplejersker tager et medansvar for, at patienternes behand- ling er evidensbaseret.
Formålet med transfusionsbehandling
I teorien får patienter blodtransfusion for at øge iltningen i vævet. Det er dog ikke sikkert, at en øgning af ilttilbuddet vil resultere i en øget lokal iltoptagelse i vævet (2). Det har længe været kendt, at tilbuddet af ilt til vævet ikke er afhængigt af patientens Hb*), så længe Hb er større end patientens kritiske niveau. Det kritiske niveau nås hurtigt ved en ukontrollabel blødning, hvorfor blodtransfusion er nødvendig her.
Det kritiske niveau
Ilttilbud (DO2) er resultatet af hjerteminutvolumen (CO) og indholdet af ilt i arterielt blod (CaO2). Iltforbruget (VO2) er normalt 4-5 gange mindre end ilttilbuddet. Derfor kan iltleveringen falde over en lang periode, før patienten påvirkes af et blodtab.
Når patientens hæmatokrit*) falder til under 25, aktiveres flere kompensatoriske mekanismer:
- pulsen stiger i et tidligt stadie af anæmien (pga. sympatisk aktivering) · CO øges
- arterielvenøs iltekstraktion*) øges.
Når patientens hæmatokrit/hæmoglobin falder ved blodtab, mindskes blodets viskositet*). En mindsket viskositet øger det venøse tilbageløb til hjertet, og dermed øges venstre ventrikels fyldning, hvis/når tabet af røde blodceller erstattes med infusion af tynde væsker, dvs. patienten bliver normovolæmisk*).
Da røde blodceller er en tyk væske, bliver blodet tyndere, dvs. at viskositeten mindskes, når cellerne erstattes med en tynd væske. Tyndere væske/blod har lettere ved at løbe tilbage til hjertet. Samtidig falder den perifere modstand i karrene (systemisk vaskulær resistance; SVR). Resultatet er, at venstre ventrikels effekt øges, hvorved hjerteminutvolumen øges (3,4,5).
Mikrocirkulation og iltoptagelse
På det mikrocirkulatoriske niveau medfører faldet i viskositeten generelt en øget blodgennemstrømning, som dog kan modvirkes af en omfordeling pga. sympatisk aktivering.
Den øgede blodgennemstrømning giver en øget iltoptagelse til vævet (O2-ER). Ved en øget iltekstraktion ses et fald i blandet venøs og/eller central venøs iltsaturation i blodet (ScvO2) (6). Det kritiske niveau for patienten opstår, når ilttilbuddet bliver mindre end behovet for ilt, og patienten begynder at få vævshypoksi*). Hæmoglobinværdien på dette niveau defineres som den ”kritiske hæmoglobin”. Det kritiske niveau af ilttilbuddet indikerer et systemisk niveau, dvs. for hele kroppen, men det kritiske punkt for det enkelte organ kan opstå, før det kritiske punkt er nået for hele kroppen (7).
Både det kritiske niveau af ilttilbuddet og den kritiske hæmoglobin afhænger af sygdom og patientkategori. F.eks. kan man hos hjertepatienter se tidlig udvikling af iskæmiske komplikationer som eleverede ST-segmentforandringer, arytmier på organniveau og hæmodynamisk instabilitet på systemniveau. Under anæstesi ses der ligeledes et ændret behov for mikrocirkulatorisk iltning; på dette område mangler der dog evidens. 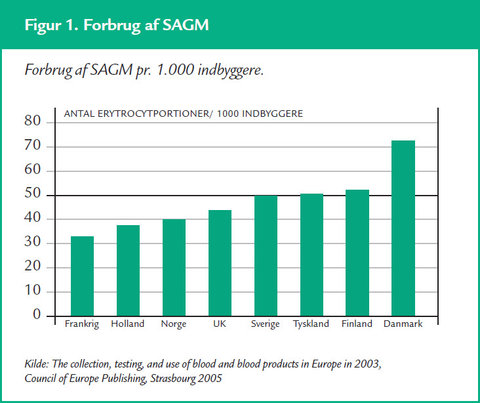
Blodtransfusion øger ikke nødvendigvis ilttilbuddet
Kliniske studier har vist, at man kan have meget lave hæmoglobinniveauer uden at møde det kritiske niveau.
Et studie fra 1998 ønskede at belyse den kardiovaskulære og vævshypoksiske reaktion, når personer med normal fysiologi bløder ned til Hb 3,1 mmol/l, hæmatokrit 15 (tabt blod erstattes med væsker, kolloid/krystalloidopløsninger, og venøs saturation holdes på 75 pct.) (8).
Resultatet var, at en rask forsøgsperson kan tåle Hb på 3,1 mmol/l, uden at der opstår mærkbar ændring i ilttilbuddet til vævet, hvilket skyldes de ovenfor nævnte kompensatoriske mekanismer (9). Studiet demonstrerede dermed, at raske mennesker har en høj tolerance for akut normovolæmisk anæmi.
Om blodtransfusion øger ilttilbuddet, afhænger af kroppens reaktion på blodtabet. I mange situationer øger blodtransfusion ikke ilttilbuddet, men dæmper i stedet den sympatiske respons. Det samlede resultat kan blive, at CO falder, hvilket medfører, at transfusionerne ikke nødvendigvis har øget ilttilbuddet, og patienten dermed ikke får den ønskede positive iltningseffekt af transfusionerne (10).Således viste et review af Hebert et al. af 18 studier, at Hb steg i alle studier, men ilttilbuddet blev kun dokumenteret øget i 14 af de 18 studier. Kun fire af studierne kunne vise, at VO2 blev øget efter blodtransfusionen (11,12).
Restriktiv transfusionsstrategi har effekt
Flere studier har vist, at patienter udsat for restriktiv transfusionsstrategi har et bedre klinisk udkomme målt i
- infektion
- mortalitet
- multiorgansvigt
- indlæggelsestid på hospital og på intensivt afsnit
- organspecifikke komplikationer og andre undersøgte komplikationer.
Dette er nogle af årsagerne til, at der stadig er stor interesse for at formulere evidensbaserede vejledninger til ikkeblødende patienter (13,14,15,16,17).
Bivirkninger ved transfusion
Indtil 1990’erne var opmærksomheden mod blodtransfusion rettet mod morbiditet og mortalitet grundet transfusionsoverførte sygdomme. Som et resultat af dette er risikoen for overførsel af bl.a. hiv og hepatitis C ved blodtransfusion mindsket kraftigt over de sidste 20 år pga. teknologiske forbedringer i blodproduktionen.
Alligevel er der kommet flere observationsstudier og randomiserede kontrollerede undersøgelser, der viser forhøjet dødelighed hos patienter, som har fået blodtransfusion. Dette indgår ikke i vores klassiske opfattelse af transfusionskomplikationer, da det formentlig skyldes nogle patofysiologiske mekanismer, vi endnu ikke er helt sikre på (1). Uanset de patofysiologiske mekanismer er der evidens for negative effekter af blodtransfusion.
Det drejer sig om øget morbiditet og immunsuppression, der prædisponerer for infektion og postoperative infektioner (13,14). Transfusion Related Acute Lung Injury*) (TRALI), og andre immunologiske reaktioner ses også (18).
Restriktiv transfusionsstrategi anbefales til kritisk syge
Transfusion Requirements in Critical Care studiet fra 1999 var det første større randomiserede kliniske studie, der ønskede at belyse, om intensivpatienter havde et dårligere outcome, hvis de først blev transfunderet, når deres Hb var faldet til 4,4 i forhold til 6,0. I alt 838 patienter blev randomiserede.
418 patienter i en restriktiv gruppe, som først skulle have donorblod, når deres Hb var faldet til < 4,4 mmol/l. Den anden gruppe på 420 patienter kom i en liberal gruppe, hvor de allerede fik blodtransfusion, når deres Hb var faldet til < 6,0 mmol/l. Studiet viste, at de restriktivt behandlede patienter havde en signifikant lavere dødelighed set over 30 dages indlæggelse (22,2 pct. versus 28,1 pct.; P=0,05).
Et sekundært effektmål viste endvidere, at de liberalt transfunderede patienter havde en signifikant øget forekomst af AMI og lungeødem. Selv om den øgede forekomst af lungeødem kan forklares ud fra overload, modsiges dette af den formodede effekt af, at en liberal transfusionsstrategi skulle give en øget iltning af myokardiet, hvormed myokardiets funktion burde være øget (15).
Patienter, der modtog blodtransfusion ved Hb < 4,4 mmol/l, havde
- øget overlevelse, hvis de var under 55 år
- øget overlevelse, hvis deres Acute Physiology And Chronic ealth Evaluation*) (APACHE II)-score var under 20
- generelt lavere mortalitet under indlæggelsen
- signifikant lavere eksposition /udsættelse for donorblodprodukter.
Konklusionen på studiet var, at en restriktiv transfusionsstrategi er lige så god og måske bedre til kritisk syge patienter. En subgruppeundersøgelse viste dog, at iskæmisk hjertesyge patienter havde mindre mortalitet, når de hørte til den liberale grænse, hvorfor vejledningen til disse patienter i dag er en liberal strategi (Hb 6,0 mod Hb 4,5 mmol/l).
Et nyt RCT-studie fra 2010 sammenlignede 502 bypassopererede patienter. Patienterne blev fordelt i en restriktiv gruppe (Hb 5,0) og en liberal gruppe (Hb 6,0). Studiet viste, at patienterne i den restriktive gruppe klarede sig lige så godt som patienterne i den liberale gruppe (19).
Murphy et al. sammenlignede 8.516 engelske patienter, som i perioden 1996-2003 var udsat for hjertekirurgi. Når de transfunderede og ikke-transfunderede patienter var reguleret for konfunderende faktorer*), viste opgørelsen, at blodtransfusion var associeret med en øget risiko for både 30-dages og etårs mortalitet (16).
Marik et al.s systematiske review fra 2008 undersøgte sammenhængen mellem blodtransfusion og mortalitet og morbiditet hos kritisk syge patienter. De inkluderede 45 kohortestudier. Resultaterne viste, at sammenfaldet mellem blodtransfusion og død var en OR*) på 1,7, og risikoen for infektioner var OR 1,8 (17).
Yderligere har andre kliniske observationer støttet hypotesen om, at transfusion med donorblod generelt kan være relateret til multiorgansvigt (MOF) hos intensive patienter. Et prospektivt observationelt studie af Bernard et al. viste, at risikoen for 30-dages mortalitet, sårinfektion, pneumoni og septisk shock hos kirurgiske patienter signifikant øges ved en pose SAGM, og at risikoen stiger, hvis patienten får to poser SAGM (14).
Akutte risici og forsinkede reaktioner
Ud over de viste sammenhænge mellem transfusion, død og infektioner er der fortsat de klassiske risici, som kan inddeles i akutte og forsinkede, bl.a.:
Akutte
- akut hæmolyse pga. fejltransfusion
- feber (non-hæmolytisk transfusionsreaktion)
- allergi (anafylaksi, nældefeber, hypotension)
- Transfusion Related Acute Lung Injury
- bakterieoverførsel
- lungeødem, AMI, kardiogent shock (overload).
Akutte risici til massiv transfusion
- hyperkaliæmi (evt. hjertestop)
- citratforgiftning/hypokalcæmi
- hypotermi, hvilket kan føre til hypokoagulation/øget blødningstendens.
Også de forsinkede reaktioner er det vigtigt at være opmærksom på. Disse kan vise sig som:
- immunisering mod allogene celler (såvel røde som hvide blodceller)
- forsinket hæmolyse (medfører fald i Hb og stigning i bilirubin og LDH)
- virusoverførsel af f.eks. hepatitis, hiv, vest-nil-virus, cytomegalovirus, SARS, influenza etc.
- nedsat immunfunktion og deraf øget forekomst af infektioner
- cancerrecidiv (i visse tilfælde; der mangler evidens på området)
- Graft-versus-host sygdom (GvH; celler fra donor angriber eller i værten).
Gældende retningslinjer
I den gældende blodtransfusionsvejledning fra Sundhedsstyrelsen 2007 og Region Hovedstadens retningslinjer er transfusion med SAG-M indikeret ved:
1. akut livstruende blodtab uanset Hb-niveau
2. Hb < 6,0 mmol/l og samtidig:
- svær iskæmisk hjertesygdom
- septisk schock (i den initiale fase, < 6 timer)
- akut, alvorlig blødning (f.eks. tab > 30 pct. af blodvolumen inden for 24 timer).
Til øvrige patienter overvejes behandling med SAGM ved Hb <4,5 mmol/l.
Såfremt der ordineres behandling uden for de anbefalede indikationsrammer, har lægen pligt til nærmere at begrunde indikationen i journalen. Den videre behandling af akut, kontrollabel blødning omfatter indgift af friskfrosset plasma og trombocytter. Garcia-Erce et al. har i 2009 udspecificeret transfusionsgrænser i henhold til nuværende international evidens.
De har sat en nedre grænse for behandling på Hb 3,1 mmol/l modsat Sundhedsstyrelsens Hb 4,5 mmol/l. Forskerne er til gengæld enige med Sundhedsstyrelsen i, at patienter ikke skal transfunderes, hvis Hb > 6 mmol/l (20).
Konklusion
Nuværende evidens taler for at være restriktiv med blodtransfusion, og det er muligt at konkludere, at transfusion med SAGM
- er livreddende ved blødning med kredsløbssvigt
- aldrig er vist gavnlig ved Hb > 6 mmol/l
- bør gives til kritisk syge ved Hb 4,2-4,5 mmol/l
- kan gives ved Hb 3-4 mmol/l hos raske, men beslutningen afhænger af en klinisk vurdering af den enkelte patient
- kan gives ved Hb 5-6 mmol/l hos akut hjertesyge, men det afhænger af en klinisk vurdering af den enkelte patient. Studier
viser, at ikke alle patienter pr. automatik skal have blodtransfusion ved Hb < 6,0.
Vi ved også, at blodtransfusioner
- har til hensigt at øge vævsiltningen og forbedre patientens outcome, men at blodtransfusioner ikke bør gives uden evidens
for øget iltning eller hæmostase - aldrig bør gives profylaktisk
- aldrig kan anses som risikofri.
Om blodtransfusioner faktisk opfylder disse hensigter, kan være svært at estimere af flere årsager: Patientens fysiologi kan kompensere for akut anæmi, men anæmitolerancen er afhængig af patientens kardiopulmonale status og øvrige tilstand/sygdom. Der er stadig mangel på studier, der belyser vævsiltning ved forskellige sygdomme i klinisk transfusionspraksis.
Dette er specielt vigtigt for at kunne evaluere, om en øgning af hæmatokrit og blodets viskositet påvirker fysiologiske mekanismer, der ellers kompenserer for blodtab. Dvs. at ilttilbuddet ikke øges, selvom mængden af hæmoglobin øges. Det betyder, at monitorering af iltoptagelsen er specielt vigtig, når effekten af blodtransfusion skal evalueres. Manglen på fuldstændig evidens betyder således, at det er for usikkert at have en præcis nedre Hb-grænse i alle situationer. Den nuværende blodtransfusionsvejledning tager højde for dette, ved at patienterne transfunderes i god tid, før de når deres kritiske Hb.
Grunden til, at vi ikke kan benytte traditionelle symptomer på anæmi (hypotension, takykardi, dyspnø, svimmelhed og træthed), er, at symptomerne er afhængige af patientens alder, medicinering og andre sygdomme. Symptomerne bør bruges i sammenhæng med patientens Hb ved beslutning om at transfundere eller afvente. Uanset disse forbehold belyste TRICC-studiet, at restriktiv brug af donorblod kan være optimalt for patienten.
Beslutningen, om en patient skal have donorblod, bør træffes af klinikkens personale ud fra Hb og den aktuelle evidens for den specifikke patientkategori, patientens andre sygdomme, anden medicinering samt værdier som BT, puls, venøs saturation etc.
På nuværende tidspunkt kan vi konkludere, at blodtransfusion til patienter med Hb > 6,0 mmol/l er unødvendig. Der mangler studier, der viser fordele/ulemper for onkologiske patienters oplevelse af almen tilstand efter blodtransfusion og for de sygeste patienter med tegn på svær iskæmi. Men alt i alt betyder nuværende evidens, at alt for mange patienter i Danmark stadig får unødvendige blodtransfusioner.
Den næste og største udfordring bliver derfor, at det kliniske personale ændrer behandling til den internationalt anerkendte restriktive strategi for behandling med donorblod.
Jens Svanholt Seeberg er født i 1969. Han blev sygeplejerske i år 2000 og cand.scient.san. i 2006. Jens Svanholt Seeberg er ansat som sygeplejefaglig blodmanager på Rigshospitalet. Frem til denne ansættelse har han været ansat forskellige steder både som basissygeplejerske og som sygeplejerske med ansvar for udvikling og forskning.
Tak til Anders Perner, overlæge, ITA-4131, Rigshospitalet, for kritisk gennemlæsning af denne artikel.
Litteratur
- Eleftherios et al. Blood Still Kills: Six Strategies to Further Reduce Allogeneic Blood Transfusion-Related Mortality. Transfusion Medicine Review. Vol 24, No 2 (April), 2010:pp 77-124
- Fernandes CJ Jr, Akamine N, De Marco FVC et al. Red blood cell transfusion does not increase oxygen consumption in critically ill septic patients. Crit Care 5:362-7,2001.
- Habler OP, Kleen MS, Hutter J et al. Effects of hyperoxic ventilation on hemodilutioninduced changes in anesthetized dogs. Transfusion 1998;38:135-44
- Habler OP, Kleen MS, Podtschaske AH et al. The effect of acute normovolemic hemodilution (ANH) on myocardial contractility in anesthetized dogs. Anesth Analg. 1996;83:451-8
- Cabrales P, Intaglietta M, Tsai AG. Transfusion restores blood viscosity and reinstates microvascular conditions from hemorrhagic shock independent of oxygen carrying capacity. Resuscitation 2007;75:124-34
- Habler OP, Messmer KF. The physiology of oxygen transport. Transfus Sci 1997;18:425-35.
- Pape A, Habler O. Alternatives to allogeneic blood transfusion. Best pract Res Clin Anaesthesiol 2007;21:221-39.
- Krantz T, Warberg J, Secher NH. Venous oxygen saturation during normovolaemic haemodilution in the pig. Acta Anaesthesiol Scand. 2005;49:1149-56
- Weiskopf RB, Viele MK, Feiner J et al. Human cardiovascular and metabolic response to acute, severe isovolemic anemia. JAMA. 1998;279:217-21
- Vincent et al. Best Pract Res Clin 2007
- Surgenor Sd, Hampers MJ, Corwin HL. Is blood transfusion good for the heart? Critt Care Med 29:442-4,2001.
- Stiner ME, Stowell C. Does red-blood-cell storage affect clinical outcome? When in doubt, do the experiment. Transfusion 49:1286-90,2009
- Banbury MK, Brizzo ME, Rajeswaran J, Lytle BW, Blackstone EH. Transfusion increase the risk of postoparative infection after surgery. J Am Coll Surg. 2006 Jan;202(1):131-8.
- Bernard et al. Intraoperative Transfusion of 1 U to 2 U Packed Red Blood Cells Is Associated with Increased 30-Day Mortality, Surgical-Site Infection, Pneumonia, and Sepsis in General Surgery Patients. J Am Coll Surg. 2009
- May;208(5):931-7.
- Herbert et al. A multicenter randomized trial of transfusion requirements in critical care. N Engl J Med 340:409-17,1999.
- Murphy GJ, Reeves BC, Rogers CA, et al. Increased mortality, postoperative morbidity, and cost after red-blood-cell transfusion in patients having cardiac surgery. Circulation 116:2544-52,2007.
- Marik PE, Corwin HL: Efficacy of red-blood-cell transfusion in the critically ill: A systematic review of the literature. Critt Care Med 36:2667-74,2008.
- Spiess et al. Transfusion 2004;44:4S-14S.
- Hajjar LA, Vincent JL, Galas FRBG, et al. Transfusion requirements After Surgery: the TRACS randomized controlled Trial. JAMA, 2010;304(14):1559-67.
- Garcia-Erce et al.: Blood transfusion for the treatment of acute anemia in inflammatory bowel disease and other digestive diseases. World J Gastroenterology, 2009 October 7;15(37):4686-94.
Svanholt Seeberg J. When does the patient need a blood transfusion?. Sygeplejersken 2011;(8):58-63.
Main message In the Western world, Denmark transfuses more red blood cells per 1,000 inhabitants than any other country. Simultaneously, there is currently evidence that many patients receive unnecessary blood transfusions.
These unnecessary transfusions should be eliminated by using evidenced-based transfusion guidelines that present the likelihood of whether the treatment would provide an overall benefit for the patient. Results Traditional symptoms of anaemia should only be used in association with the patient's Hb when deciding on transfusions. Studies show
That transfusion with SAGM is life-saving during bleeding with circulatory failure, but has never been shown to be beneficial with an Hb > 6 mmol/l.
- The critically ill patient should be transfused when Hb is 4.2 – 4.5 mmol/l.
- There is some evidence for the need for transfusion when Hb is 3 – 4 mmol/l in healthy persons
- There is some evidence for the need for transfusion when Hb is 5 – 6 mmol/l in patients with acute heart disease.
Nursing implications Internationally, nurses are developing blood management concepts for optimising the use of blood transfusions. Towards this end, interdisciplinary team structures have are used to apply current evidence to meet the patients' needs for best current practice and nursing.
Key words:Transfusion guidelines, blood management, restrictive transfusion strategy
